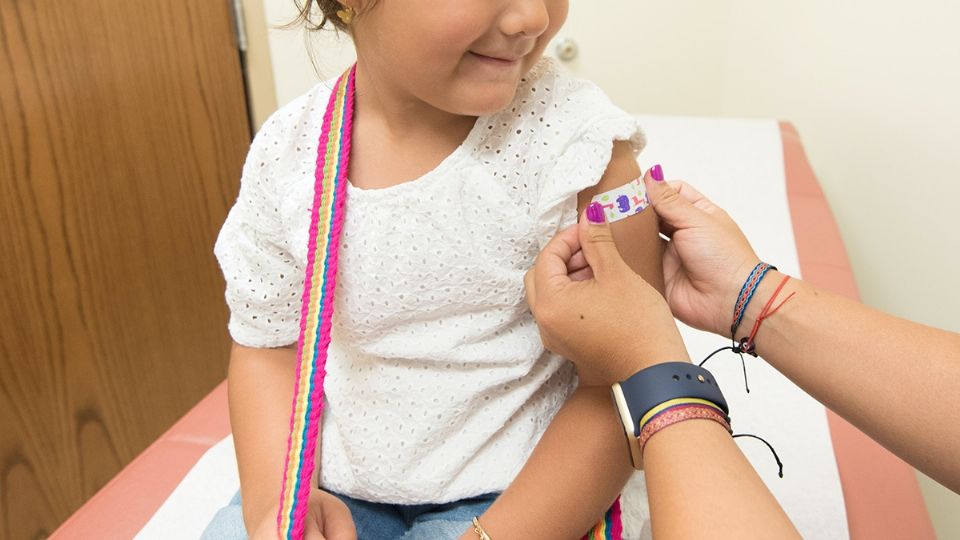
Este martes, la farmacéutica Pfizer y la empresa BioNTech SE presentaron los primeros datos del ensayo clínico de la vacuna contra Covid-19 en niños de 5 a 11 años y dieron a conocer que próximamente emitirían una solicitud formal a las autoridades estadounidenses para que se considere su uso de emergencia.
A inicios de Septiembre, la Administración de Alimentos y Medicamentos (FDA) de Estados Unidos dijo que buscaba completar la evaluación de datos sobre el ensayo en este grupo de edad cuanto antes, en cuestión de semanas y no de meses.
Te podría interesar
Esto amplía las posibilidades de que sea aprobada para su uso en niños de 5 años en adelante para finales de octubre, indicó una fuente a Reuters.
El biológico de Pfizer/BioNTech fue autorizado para su uso en menores de 12 a 15 años alrededor de un mes después de que se solicitara su aprobación de emergencia.
De seguir los mismos tiempos que el grupo anterior, los menores de cinco años en adelante podrían ser vacunados aproximadamente a finales de octubre.
De acuerdo con la Academia Americana de Pediatría, a principios de este mes, en Estados Unidos, los casos de infección por coronavirus en menores de edad se dispararon a su punto más alto, por lo que millones de ciudadanos esperan con ansias la aprobación de la vacuna contra Covid-19 en niños de 5 a 11 años.
La autorización del biológico para este grupo de edad podría ayudar a mitigar una nueva ola de contagios este otoño, puesto que las escuelas ya están abiertas en todo Estados Unidos.
Pese a que la probabilidad de que los menores contraigan Covid-19 es baja, sí pueden volverse portadores del coronavirus y contagiar a otras personas, entre ellas la población más vulnerable a desarrollar la forma grave de la enfermedad.
Pfizer y BioNTech dijeron que tiene previsto presentar los datos sobre la vacuna contra Covid-19 en niños de 5 a 11 años a la Agencia Europea del Medicamento y otras instituciones reguladores, además de los datos de la última face para darlos a conocer en una publicación científica.